Самое важное, уникальное по свойствам и составу вещество нашей планеты - это, конечно, вода. Ведь именно благодаря ей на Земле жизнь есть, в то время как на других известных сегодня объектах Солнечной системы ее нет. Твердая, жидкая, в виде пара - она нужна и важна любая. Вода и ее свойства составляют предмет изучения целой научной дисциплины - гидрологии.
Количество воды на планете
Если рассматривать показатель количества данного оксида во всех агрегатных состояниях, то его на планете около 75% от общей массы. При этом следует учитывать связанную воду в органических соединениях, живых существах, минералах и прочих элементах.
Если учитывать только жидкое и твердое состояние воды, показатель падет до 70,8%. Рассмотрим, как распределяются эти проценты, где содержится рассматриваемое вещество.
- Соленой воды в океанах и морях, солончаковых озерах на Земле 360 млн км 2 .
- Пресная вода распределена неравномерно: ее в ледниках Гренландии, Арктики, Антарктиды заковано во льды 16,3 млн км 2 .
- В пресных реках, болотах и озерах сосредоточено 5,3 млн км 2 оксида водорода.
- Подземные воды составляют 100 млн м 3 .
Именно поэтому космонавтам из далекого космического пространства видно Землю в форме шара голубого цвета с редкими вкраплениями суши. Вода и ее свойства, знание особенностей строения являются важными элементами науки. К тому же, в последнее время человечество начинает испытывать явную нехватку пресной воды. Может быть, такие знания помогут в решении данной проблемы.
Состав воды и строение молекулы
Если рассмотреть эти показатели, то сразу станут понятны и свойства, которые проявляет это удивительное вещество. Так, молекула воды состоит из двух атомов водорода и одного атома кислорода, поэтому имеет эмпирическую формулу Н 2 О. Кроме того, при построении самой молекулы большую роль играют электроны обоих элементов. Посмотрим, что собой представляют структура воды и ее свойства.

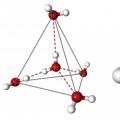
Очевидно, что каждая молекула ориентирована вокруг другой, и все вместе они формируют общую кристаллическую решетку. Интересно то, что оксид построен в форме тетраэдра - атом кислорода в центре, а две пары электронов его и два атома водорода вокруг асимметрично. Если провести через центры ядер атомов линии и соединить их, то получится именно тетраэдрическая геометрическая форма.
Угол между центром атома кислорода и ядрами водородов составляет 104,5 0 С. Длина связи О-Н = 0,0957 нм. Наличие электронных пар кислорода, а также его большее в сравнении с водородами сродство к электрону обеспечивают формирование в молекуле отрицательно заряженного поля. В противовес ему ядра водородов образуют положительно заряженную часть соединения. Таким образом, выходит, что молекула воды - диполь. Это определяет то, какой может быть вода, и ее физические свойства также зависят от строения молекулы. Для живых существ эти особенности играют жизненно важную роль.
Основные физические свойства
К таковым принято относить кристаллическую решетку, температуры кипения и плавления, особенные индивидуальные характеристики. Все их и рассмотрим.
- Строение кристаллической решетки оксида водорода зависит от агрегатного состояния. Оно может быть твердым - лед, жидким - основная вода при обычных условиях, газообразным - пар при повышении температуры воды свыше 100 0 С. Красивые узорные кристаллы формирует лед. Решетка в целом рыхлая, но соединение очень прочное, плотность низкая. Видеть ее можно на примере снежинок или морозных узоров на стеклах. У обычной воды решетка не имеет постоянной формы, она изменяется и переходит из одного состояния в другое.
- Молекула воды в космическом пространстве имеет правильную форму шара. Однако под действием земной силы тяжести она искажается и в жидком состоянии принимает форму сосуда.
- То, что по структуре оксид водорода - диполь, обуславливает следующие свойства: высокая теплопроводность и теплоемкость, которая прослеживается в быстром нагревании и долгом остывании вещества, способность ориентировать вокруг себя как ионы, так и отдельные электроны, соединения. Это делает воду универсальным растворителем (как полярным, так и нейтральным).
- Состав воды и строение молекулы объясняют способность этого соединения образовывать множественные водородные связи, в том числе с другими соединениями, имеющими неподеленные электронные пары (аммиак, спирт и прочие).
- Температура кипения жидкой воды - 100 0 С, кристаллизация наступает при +4 0 С. Ниже этого показателя - лед. Если же увеличивать давление, то температура кипения воды резко возрастет. Так, при высоких атмосферах в ней можно растопить свинец, но она при этом даже не закипит (свыше 300 0 С).
- Свойства воды весьма значимы для живых существ. Например, одно из самых важных - поверхностное натяжение. Это формирование тончайшей защитной пленки на поверхности оксида водорода. Речь идет о воде в жидком состоянии. Эту пленку разорвать механическим воздействием очень сложно. Учеными установлено, что понадобится сила, равная весу в 100 тонн. Как ее заметить? Пленка очевидна, когда вода капает из крана медленно. Видно, что она словно в какой-то оболочке, которая растягивается до определенного предела и веса и отрывается в виде круглой капельки, слегка искаженной силой тяжести. Благодаря поверхностному натяжению многие предметы могут находиться на поверхности воды. Насекомые, имеющие особые приспособления, могут свободно передвигаться по ней.
- Вода и ее свойства аномальны и уникальны. По органолептическим показателям данное соединение - бесцветная жидкость без вкуса и запаха. То, что мы называем вкусом воды, - это растворенные в ней минералы и другие компоненты.
- Электропроводность оксида водорода в жидком состоянии зависит от того, сколько и каких солей в нем растворены. Дистиллированная вода, не содержащая никаких примесей, электрический ток не проводит.
Лед - это особое состояние воды. В структуре этого ее состояния молекулы связаны друг с другом водородными связями и формируют красивую кристаллическую решетку. Но она достаточно неустойчива и легко может расколоться, растаять, то есть деформироваться. Между молекулами сохраняется множество пустот, размеры которых превышают размеры самих частиц. Благодаря этому плотность льда меньше, чем жидкого оксида водорода.

Это имеет большое значение для рек, озер и прочих пресных водоемов. Ведь в зимний период вода в них не замерзает полностью, а лишь покрывается плотной коркой более легкого льда, всплывающего наверх. Если бы данное свойство не было характерно для твердого состояния оксида водорода, то водоемы промерзали бы насквозь. Жизнь под водой была бы невозможна.
Кроме того, твердое состояние воды имеет большое значение как источник огромного количества питьевых пресных запасов. Это ледники.
Особенным свойством воды можно назвать явление тройной точки. Это такое состояние, при котором лед, пар и жидкость могут существовать одновременно. Для этого требуются такие условия, как:
- высокое давление - 610 Па;
- температура 0,01 0 С.
Показатель прозрачности воды варьируется в зависимости от посторонних примесей. Жидкость может быть полностью прозрачной, опалесцентной, мутной. Поглощаются волны желтого и красного цветов, глубоко проникают лучи фиолетовые.

Химические свойства
Вода и ее свойства - важный инструмент в понимании многих процессов жизнедеятельности. Поэтому они изучены очень хорошо. Так, гидрохимию интересуют вода и ее химические свойства. Среди них можно назвать следующие:
- Жесткость. Это такое свойство, которое объясняется наличием солей кальция и магния, их ионов в растворе. Подразделяется на постоянную (соли названных металлов: хлоридов, сульфатов, сульфитов, нитратов), временную (гидрокарбонаты), которая устраняется кипячением. В России воду перед использованием смягчают химическим путем для лучшего качества.
- Минерализация. Свойство, основанное на дипольном моменте оксида водорода. Благодаря его наличию молекулы способны присоединять к себе множество других веществ, ионов и удерживать их. Так формируются ассоциаты, клатраты и прочие объединения.
- Окислительно-восстановительные свойства. Как универсальный растворитель, катализатор, ассоциат, вода способна взаимодействовать с множеством простых и сложных соединений. С одними она выступает в роли окислителя, с другими - наоборот. Как восстановитель реагирует с галогенами, солями, некоторыми менее активными металлами, с многими органическими веществами. Последние превращения изучает органическая химия. Вода и ее свойства, в частности, химические, показывают, насколько она универсальна и уникальна. Как окислитель она вступает в реакции с активными металлами, некоторыми бинарными солями, многими органическими соединениями, углеродом, метаном. Вообще химические реакции с участием данного вещества нуждаются в подборе определенных условий. Именно от них и будет зависеть исход реакции.
- Биохимические свойства. Вода является неотъемлемой частью всех биохимических процессов организма, являясь растворителем, катализатором и средой.
- Взаимодействие с газами с образованием клатратов. Обычная жидкая вода может поглощать даже неактивные химически газы и располагать их внутри полостей между молекулами внутренней структуры. Такие соединения принято называть клатратами.
- Со многими металлами оксид водорода формирует кристаллогидраты, в которые он включен в неизменном виде. Например, медный купорос (CuSO 4 *5H 2 O), а также обычные гидраты (NaOH*H 2 O и другие).
- Для воды характерны реакции соединения, при которых происходит образование новых классов веществ (кислот, щелочей, оснований). Они не являются окислительно-восстановительными.
- Электролиз. Под действием электрического тока молекула разлагается на составные газы - водород и кислород. Один из способов получения их в лаборатории и промышленности.
С точки зрения теории Льюиса вода - это слабая кислота и слабое основание одновременно (амфолит). То есть можно сказать о некоей амфотерности в химических свойствах.

Вода и ее полезные свойства для живых существ
Сложно переоценить то значение, которое имеет оксид водорода для всего живого. Ведь вода и есть сам источник жизни. Известно, что без нее человек не смог бы прожить и недели. Вода, ее свойства и значение просто колоссальны.
- Это универсальный, то есть способный растворять и органические, и неорганические соединения, растворитель, действующий в живых системах. Именно поэтому вода - источник и среда для протекания всех каталитических биохимических преобразований, с формированием сложных жизненно важных комплексных соединений.
- Способность образовывать водородные связи делает данное вещество универсальным в выдерживании температур без изменения агрегатного состояния. Если бы это было не так, то при малейшем снижении градусов она превращалась бы в лед внутри живых существ, вызывая гибель клеток.
- Для человека вода - источник всех основных бытовых благ и нужд: приготовление пищи, стирка, уборка, принятие ванны, купание и плавание и прочее.
- Промышленные заводы (химические, текстильные, машиностроительные, пищевые, нефтеперерабатывающие и другие) не сумели бы осуществлять свою работу без участия оксида водорода.
- Издревле считалось, что вода - это источник здоровья. Она применялась и применяется сегодня как лечебное вещество.
- Растения используют ее как основной источник питания, за счет чего они продуцируют кислород - газ, благодаря которому существует жизнь на нашей планете.
Можно назвать еще десятки причин того, почему вода - это самое широко распространенное, важное и необходимое вещество для всех живых и искусственно созданных человеком объектов. Мы привели только самые очевидные, главные.

Гидрологический цикл воды
Иными словами, это ее круговорот в природе. Очень важный процесс, позволяющий постоянно пополнять исчезающие запасы воды. Как он происходит?
Основных участников трое: подземные (или грунтовые) воды, поверхностные воды и Мировой океан. Важна также и атмосфера, конденсирующая и выдающая осадки. Также активными участниками процесса являются растения (в основном деревья), способные поглощать огромное количество воды в сутки.
Итак, процесс происходит следующим образом. Грунтовые воды заполняют подземные капилляры и стекаются к поверхности и Мировому океану. Затем поверхностные воды поглощаются растениями и транспирируются в окружающую среду. Также происходит испарение с огромных площадей океанов, морей, рек, озер и прочих водоемов. Попав в атмосферу, вода что делает? Конденсируется и проливается обратно в виде осадков (дождь, снег, град).
Если бы не происходили эти процессы, то запасы воды, особенно пресной, давно бы уже закончились. Именно поэтому охране и нормальному гидрологическому циклу уделяется людьми большое внимание.
Понятие о тяжелой воде
В природе оксид водорода существует в виде смеси изотопологов. Это связано с тем, что водород формирует три вида изотопа: протий 1 Н, дейтерий 2 Н, тритий 3 Н. Кислород, в свою очередь, также не отстает и образует три устойчивые формы: 16 О, 17 О, 18 О. Именно благодаря этому существует не просто обычная протиевая вода состава Н 2 О (1 Н и 16 О), но еще и дейтериевая, и тритиевая.

При этом устойчива по структуре и форме именно дейтериевая (2 Н), которая включается в состав практически всех природных вод, но в малом количестве. Именно ее называют тяжелой. Она несколько отличается от обычной или легкой по всем показателям.
Тяжелая вода и ее свойства характеризуются несколькими пунктами.
- Кристаллизуется при температуре 3,82 0 С.
- Кипение наблюдается при 101,42 0 С.
- Плотность составляет 1,1059 г/см 3 .
- Как растворитель в несколько раз хуже легкой воды.
- Имеет химическую формулу D 2 O.
При проведении опытов, показывающих влияние подобной воды на живые системы, было установлено, что жить в ней способны лишь некоторые виды бактерий. Для приспособления и акклиматизации колониям потребовалось время. Но, приспособившись, они полностью восстановили все жизненно важные функции (размножение, питание). Кроме того, стали очень устойчивы к воздействию радиоактивного излучения. Опыты на лягушках и рыбах положительного результата не дали.
Современные области применения дейтерия и образованной им тяжелой воды - атомная и ядерная энергетика. Получить в лабораторных условиях такую воду можно при помощи электролиза обычной - она образуется как побочный продукт. Сам дейтерий формируется при многократных перегонках водорода в специальных устройствах. Применение его основано на способности замедлять нейтронные синтезы и протонные реакции. Именно тяжелая вода и изотопы водорода - основа для создания ядерной и водородной бомбы.
Опыты на применении дейтериевой воды людьми в небольших количествах показали, что задерживается она недолго - полный вывод наблюдается через две недели. Употреблять ее в качестве источника влаги для жизни нельзя, однако техническое значение просто огромно.
Талая вода и ее применение
Свойства такой воды издревле были определены людьми как целебные. Давно было замечено, что при таянии снега животные стараются напиться водой из образовавшихся лужиц. Позже были тщательно исследованы ее структура и биологическое воздействие на организм человека.

Талая вода, ее признаки и свойства находятся посередине между обычной легкой и льдом. Изнутри она образована не просто молекулами, а набором кластеров, сформированных кристаллами и газом. То есть внутри пустот между структурными частями кристалла находятся водород и кислород. По общему виду строение талой воды сходно со строением льда - сохраняется структурность. Физические свойства такого оксида водорода незначительно меняются в сравнении с обычным. Однако биологическое воздействие на организм отличное.
При замораживании воды первой фракцией превращается в лед более тяжелая часть - это дейтериевые изотопы, соли и примеси. Поэтому эту сердцевину следует удалять. А вот остальная часть - чистая, структурированная и полезная вода. Каково воздействие на организм? Учеными Донецкого НИИ были названы следующие виды улучшений:
- Ускорение восстановительных процессов.
- Укрепление иммунитета.
- У детей после ингаляций такой водой происходит восстановление и излечение простудных заболеваний, проходит кашель, насморк и прочее.
- Улучшается дыхание, состояние гортани и слизистых оболочек.
- Общее самочувствие человека, активность повышаются.
Сегодня существует ряд сторонников лечения именно талой водой, которые пишут свои положительные отзывы. Однако есть ученые, в том числе медики, которые эти взгляды не поддерживают. Они считают, что вреда от такой воды не будет, но и пользы мало.
Энергетика
Почему свойства воды могут изменяться и восстанавливаться при переходе в разные агрегатные состояния? Ответ на этот вопрос следующий: у данного соединения существует своя информационная память, которая записывает все изменения и приводит к восстановлению структуры и свойств в нужное время. Биоэнергетическое поле, через которое проходит часть воды (та, что поступает из космоса), несет в себе мощный заряд энергии. Эту закономерность часто используют при лечении. Однако с медицинской точки зрения не каждая вода способна оказать благоприятный эффект, в том числе и информационный.
Структурированная вода - что это?
Это такая вода, которая имеет несколько иное строение молекул, расположение кристаллических решеток (такое, которое наблюдается у льда), но это все же жидкость (талая также относится к этому типу). В этом случае состав воды и ее свойства с научной точки зрения не отличаются от тех, что характерны для обычного оксида водорода. Поэтому структурированная вода не может иметь такого широкого лечебного эффекта, который ей приписывают эзотерики и сторонники нетрадиционной медицины.
Основное вещество, которое позволяет существовать жизни на планете – это вода. Она необходима в любом состоянии. Изучение свойств жидкости привело к образованию целой науки – гидрологии. Предмет изучения большинства ученых – это физические и химические свойства . Они понимают под этими свойствами: критические температуры, кристаллическую решетку, примеси и другие индивидуальные особенности химического соединения.
Вконтакте
Изучение
Формула воды известна каждому школьнику. Это три простых знака, но содержатся они в 75% от общей массы всего на планете.
Н2О – это два атома и один — . Структура молекулы имеет эмпирическую форму, поэтому свойства жидкости такие многообразные, несмотря на простой состав. Каждая из молекул находится в окружении соседей. Они связаны одной кристаллической решеткой.
Простота строения позволяет жидкости существовать в нескольких агрегатных состояниях. Ни одно вещество на планете не может этим похвастаться. Н2О очень подвижна, она уступает в этом свойстве лишь воздуху. Каждый осведомлен о круговороте воды, о том, что после испарения ее с поверхности земли, где-то далеко проходит дождь или снег. Климат регулируется именно благодаря свойствам жидкости, которая может отдавать тепло, а сама при этом практически не изменяет свою температуру.
Физические свойства
Н2О и ее свойства зависят от многих ключевых факторов. Основные из них:
- Кристаллическая решетка. Строение воды, а точнее ее кристаллической решетки, обусловлено агрегатным состоянием. Она имеет рыхлое, но очень прочное строение. Снежинки показывают решетку в твердом состоянии, а вот в привычном – жидком, у воды нет четкости в строении кристаллов, они подвижны и изменчивы.
- Строение молекулы – шар. Но влияние земного притяжения заставляет воду принимать форму сосуда, в котором находится. В космосе она будет геометрически правильной формы.
- Реагирует вода с другими веществами, в том числе с теми, кто обладает неразделенными электронными парами, среди них спирт и аммиак.
- Обладает высокой теплоемкостью и теплопроводностью , быстро нагревается и долго не остывает.
- Еще со школы известно, что температура кипения — 100 градусов Цельсия. В жидкости появляются кристаллы при понижении до +4 градусов, а вот лед образуется при еще большем снижении. Температура кипения зависит от давления, в которое поместить Н2О. Есть эксперимент, при котором температура химического соединения достигает 300 градусов, при этом жидкость не кипит, а плавит свинец.
- Еще одним важным свойством является поверхностное натяжение. Формула воды позволяет ему быть очень прочным. Ученые выяснили, чтобы разорвать его потребуется сила с массой больше 100 тонн.
Интересно! Н2О, очищенная от примесей (дистиллированная), не может проводить ток. Это свойство оксида водорода появляется лишь при наличии растворенных в нем солей.
Другие особенности
Лед – это уникальное состояние, которое свойственно оксиду водорода. Он образует рыхлые связи, которые легко деформируются. Кроме того, расстояние между частицами значительно увеличивается, делая плотность льда намного ниже жидкости. Это позволяет водоемам не промерзать полностью в зимний период, сохраняя жизнь под слоем льда. Ледники – большой запас пресной воды.
Интересно! У Н2О есть уникальное состояние, которое называется явлением тройной точки. Это когда она находится сразу в трех своих состояниях. Возможно это условие, лишь при температуре 0,01 градус и давлении 610 Па.
Химические свойства
Основные химические свойства :
- Разделяют воду по жесткости, от мягкой и средней — до жесткой. Этот показатель зависит от содержания солей магния и калия в растворе. Есть также такие , которые находятся в жидкости постоянно, а от некоторых можно избавиться кипячением.
- Окисление и восстановление. Н2О влияет на процессы, изучаемые в химии, происходящие с другими веществами: одни она растворяет, с другими вступает в реакцию. Исход любого эксперимента зависит от правильного выбора условий, при которых он проходит.
- Влияние на биохимические процессы. Вода основная часть любой клетки , в ней как в среде, происходят все реакции в организме.
- В жидком состоянии впитывает в себя газы, которые неактивны. Их молекулы располагаются между молекулами Н2О внутри полостей. Так образуются клатраты.
- При помощи оксида водорода образуются новые вещества, которые не связаны с окислительно-восстановительным процессом. Речь идет о щелочах, кислотах и основаниях.
- Еще одна характеристика воды — это способность образовывать кристаллогидраты. Оксид водорода при этом остается в неизменном виде. Среди обычных гидратов можно выделить медный купорос.
- Если через соединение пропустить электрический ток, то можно разложить молекулу на газы.

Важность для человека
Очень давно люди поняли неоценимое значение жидкости для всего живого и планеты в целом. Без нее человек не может прожить и недели. Какого же полезное действие от этого самого распространенного на Земле вещества?
- Самое главное применение — это наличие в организме, в клетках, где проходят все важнейшие реакции.
- Образование водородных связей благоприятно сказывается на живых существах, ведь при изменении температуры жидкость в теле не замерзает.
- Человек давно применяет Н2О в бытовых нуждах, кроме приготовления пищи, это: стирка, уборка, купание.
- Ни один промышленный завод не может работать без жидкости.
- Н2О – источник жизни и здоровья , она является лекарством.
- Растения используют ее на всех этапах своего развития и жизни. С ее помощью они производят кислород, такой необходимый для жизни живых существ, газ.
Кроме самых очевидных полезных свойств, их имеется еще очень много.

Важность воды для человека
Критическая температура
У Н2О, как и у всех веществ, есть температура, которая называется критической . Критическая температура воды определяется методом ее нагрева. До 374 градусов по Цельсию жидкость называют паром, она еще может превратиться обратно в привычное жидкое состояние, при определенном давлении. Когда температура вышей этой критической отметки, то вода как химический элемент, превращается в газ безвозвратно.
Применение в химии
Большой интерес у химиков Н2О вызывает благодаря основному своему свойству – умению растворять. Часто ученые ею очищают вещества, чем создают благоприятные условия для проведения экспериментов. Во многих случаях она является средой, в которой можно провести опытные испытания. Кроме того, Н2О сама участвует в химических процессах, влияя на тот или иной химический эксперимент. Она соединяется с неметаллическими и металлическими веществами.
Три состояния
 Вода предстает перед людьми в трех состояниях,
называемых агрегатными. Это жидкость, лед и газ. Вещество одно и то же по составу, но разное по свойствам. У
Вода предстает перед людьми в трех состояниях,
называемых агрегатными. Это жидкость, лед и газ. Вещество одно и то же по составу, но разное по свойствам. У
мение перевоплощаться – очень важная характеристика воды для всей планеты, таким образом, происходит ее круговорот.
Сравнивая все три состояния, человек чаще видит химическое соединение все же в жидком виде. Вода не имеет вкуса и запаха, а то, что ощущается в ней, это из-за наличия примесей, растворенных в ней веществ.
Основные свойства воды в жидком состоянии — это: огромная сила, позволяющая точить камни и рушить скалы, а также возможность принимать любую форму.
Мелкие частицы при замерзании сокращают скорость своего движения и увеличивают дистанцию, поэтому структура льда пористая и по плотности ниже жидкости. Лед применяется в холодильных установках, для различных бытовых и промышленных целей. В природе лед несет лишь разрушения, выпадая в виде града или лавины.
Газ – еще одно состояние, который образуется, когда не достигается критическая температура воды. Обычно при температуре больше 100 градусов, или испаряясь с поверхности. В природе это облака, туманы и испарения. Большую роль искусственное газообразование сыграло в техническом прогрессе в 19 веке, когда были изобретены паровые двигатели.
Количество вещества в природе
75% — такая цифра покажется огромной, но это вся вода на планете, даже та, которая находится в разных агрегатных состояниях, в живых существах и органических соединениях. Если же учесть лишь жидкое, то есть воду, находящуюся в морях и океанах, а также в твердую – в ледниках, то процент становится 70,8%.
Распределение процентного содержания примерно такое:
- моря и океаны – 74,8%
- Н2О пресных источников, распределенная неравномерно по планете, в ледниках составляет — 3,4%, а в озерах, болотах и реках лишь 1,1%.
- На подземные источники приходится примерно 20,7% от всего количества.
Характеристика тяжелой воды
Природное вещество – водород встречается в виде трех изотопов , в таком же количестве форм есть и кислород. Это позволяет выделять кроме обычной питьевой воды еще дейтериевую и тритиевую.
Дейтериевая имеет самую устойчивую форму, она встречается во всех природных источниках, но в очень малом количестве. Жидкость с такой формулой обладает рядом отличий от простой и легкой. Так, образование кристаллов в ней начинается уже при температуре 3,82 градуса. А вот температура кипения немного выше — 101,42 градуса Цельсия. У нее больше плотность и способность к растворению веществ значительно снижена. Кроме того, ее обозначают другой формулой (D2O).
Живые системы реагируют на такое химическое соединение плохо. Лишь некоторые виды бактерий смогли в нем приспособиться к жизни. Рыбы и вовсе не выдержали такого эксперимента. В организме человека, дейтерий может находиться несколько недель, а после выводится, не причиняя вреда.
Важно! Пить дейтериевую воду – нельзя!
Уникальные свойства воды. – просто.
Вывод
Широкое применение тяжелая вода нашла в ядерной и атомной промышленности, а обычная — в повсеместном.
Водород.
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью.
| Получение: 1.В промышленности: Конверсионный способ. Вначале получают водяной газ, пропуская пары воды через раскаленный кокс при 1000 °С: С + Н 2 О -tà СО + Н 2 . Затем оксид углерода (II) окисляют в оксид углерода (IV), пропуская смесь водяного газа с избытком паров воды над нагретым до 400–450 °С катализатором Fe 2 O 3: CO +H 2 O = CO 2 + H 2 . Окисление метана водяным паром: CH 4 + 2Н 2 O –(t, Ni)à4Н 2 + CO 2 Термическое разложение метана при 1200 °С: CH 4 -tà C + 2H 2 Электролиз водного раствора поваренной соли или гидроксида натрия: (NaOH) + 2Н 2 O –эл.токà 2Н 2 + O 2 2NaCl + 2H 2 O –эл.токà H 2 + Cl 2 + 2NaOH; 2. В лаборатории: Zn + 2HCl à ZnCl 2 + Н 2 2Al + 2NaOH + 6H 2 O = 2Na + 3H 2 ; Si + 2NaOH + H 2 O = Na 2 SiO 3 + 2H 2 . | Свойства: 1.С металлами: Н 2 + 2Na -tà2NaH Н 2 + Са -tà СаН 2 2. С неметаллами: 2Н 2 + O 2 à 2Н 2 O Н 2 + Cl 2 -hvà 2HCl 3Н 2 + N 2 -t, p, кат.à 2NH 3 H 2 + S à H 2 S 3. С оксидами металлов (неактивных) и неметаллов: CuO + H 2 à Cu + H 2 O 2NO + 2H 2 = N 2 + 2H 2 O. |
Водородные соединения металлов и неметаллов.
1. Ионные гидриды: Получение: Н 2 + 2Na -tà2NaH
Свойства: разлагаются водой и кислотами:
NaH + Н 2 O à NaOH + Н 2
СаН 2 + 2HCl à CaCl 2 + 2Н 2
2. Ковалентные водородные соединения:
Все газы, кроме воды (водородные связи).
Неустойчивые: фосфин и силан.
Основными свойствами обладает: аммиак.
Амфотерные свойства проявляет: вода.
Кислоты образуют в водном растворе: сероводород и галогеноводороды.
Вода.
Молекулы воды связаны водородными связями: nH 2 O = (Н 2 O) n , поэтому вода жидкая в отличии от ее газообразных аналогов H 2 S, H 2 Se и Н 2 Те.
Свойства:
1. С металлами:
а) щелочные и щелочноземельные (кроме бериллия и магния): 2Na + 2Н 2 O = 2NaOH + Н 2
б) остальные металлы в ряду активности до Н могут окисляться водяным паром до оксида при высокой температуре: Fe + 4Н 2 O-tà Fe 3 O 4 + 4Н 2
2. С оксидами щелочных и щелочноземельных металлов: Н 2 O + СаО = Са(OH) 2
3. С кислотными оксидами растворимых кислот: P 2 O 5 + 3H 2 O = 2H 3 PO 4 .
4. Гидролиз солей, бинарных соединений металлов и неметаллов:
2CuSO 4 + 2Н 2 O ⇄ (CuOH) 2 SO 4 + H 2 SO 4
Al 2 S 3 + 6H 2 O à 2Al(OH) 3 + 3H 2 S
Са 3 Р 2 + 6Н 2 О à 3Са(ОН) 2 + 2РН 3
PCl 5 + 4H 2 O à H 3 PO 4 + 5HCl
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварки металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- для получения аммиака и искусственного жидкого топлива, для гидрогенизации жиров.
Элементы IVA-группы.

Углерод.
1. Простое вещество. Имеет несколько аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Алмаз – кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло. Каждый атом углерода находится в состоянии sp 3 -гибридизации.
Графит – мягкое вещество серого цвета со слабым металлическим блеском, жирное на ощупь, проводит электрический ток. Атомы углерода находятся в состоянии sp2-гибридизации и связаны в плоские слои, состоящие из соединенных ребрами шестиугольников, наподобие пчелиных сот.
Графит – наиболее устойчивая при комнатной температуре аллотропная модификация углерода.
Карбин – мелкокристаллический порошок серого цвета, полупроводник. Его кристаллы состоят из линейных цепочек углеродных атомов, соединенных чередующимися тройными и одинарными связями, или двойными связями, углерод находится в состоянии sp-гибридизации: -С≡С-С≡С-С≡С-С≡С-
По твердости карбин превосходит графит, но значительно уступает алмазу.
Фуллерен - искусственно полученная модификация углерода, состоящая из молекул C 60 , C 70 , …. C 1020 . Эти молекулы составлены из атомов углерода, объединенных в пяти и шести угольники с общими ребрами. Это черные вещества с металлическим блеском, обладающие свойствами полупроводников. При давлении порядка 2·10 5 атм и комнатной температуре фуллерен превращается в алмаз.
Свойства углерода:
| Взаимодействие с фтором: углерод обладает низкой реакционной способностью, из галогенов реагирует только с фтором. | С + 2F 2 = CF 4 . |
| Взаимодействие с кислородом: | 2С + О 2 (недост) = 2СО (угарный газ), С + О 2 (изб) = СО 2 (углекислый газ). |
| Взаимодействие с другими неметаллами: не взаимодействует с азотом и фосфором. | С + 2S = CS 2 C + 2H 2 –t, Nià CH 4 Ca + 2C = CaC 2 ЗС + 4Al =Al 4 С 3 |
| Взаимодействие с водой: при пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород: | C + H 2 O = CO + H 2 . |
| Восстановительные свойства: углерод способен восстанавливать многие металлы из их оксидов: | 2ZnO + C –tà 2Zn + CO 4С + Fe 3 O 4 –tà 3Fe + 4CO |
| Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV): | C + 2H 2 SO 4 = CO 2 + 2SO 2 + 2H 2 O; C + 4HNO 3 = CO 2 + 4NO 2 + 2H 2 O. |
Карбиды - это соединения углерода с металлами.
Оксиды углерода.
| CO | CO 2 | |
| Характеристика | угарный газ – б\ц, б\з, ядовит | углекислый газ – б/ц, б/з |
| Молекула оксида углерода (II) имеет линейное строение. Между атомами углерода и кислорода образуется тройная связь. | Молекула СО 2 линейная, тип гибридизации углерода – sp 2 | |
| Тип оксида | несолеобразующий | кислотный |
| CO + NaOH = HCOONa (формиат натрия) 2СО + О 2 = 2СО 2 СО + Н 2 = С + Н 2 О СО + Cl 2 = COCl 2 (фосген) CO + CuO = Сu + CO 2 | С + СО 2 = 2СО. 2Mg + CO 2 = 2MgO + C. Типичный кислотный оксид. Na 2 O + CO 2 = Na 2 CO 3 , 2NaOH + CO 2 = Na 2 CO 3 + H 2 O, NaOH + CO 2 = NaHCO 3 . Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды: Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O. | |
| Получение | 1)Образуется в газогенераторах при пропускании воздуха через раскаленный уголь: C + O 2 = CO 2 , CO 2 + C = 2CO. 2)Получается при термическом разложении муравьиной или щавелевой кислоты в присутствии концентрированной серной кислоты: HCOOH = H 2 O + CO, H 2 C 2 O 4 = CO + CO 2 + H 2 O | Получают углекислый газ обжигом известняка: CaCO 3 = CaO + CO 2 , или действием сильных кислот на карбонаты и гидрокарбонаты: CaCO 3 +2HCl =CaCl 2 +H 2 O + CO 2 , NaHCO 3 + HCl =NaCl +H 2 O +CO 2 . |

УГОЛЬНАЯ КИСЛОТА Н 2 СО 3
При растворении углекислого газа в воде образуется очень слабая угольная кислота Н 2 СО 3 .
Углекислый газ в воде находится преимущественно в виде гидратированных молекул СО 2 и лишь в незначительной степени в форме угольной кислоты. При этом в растворе устанавливается равновесие:
СО 2(г) + Н 2 О ⇄ СО 2 · Н 2 О (раствор) ⇄ Н 2 СО 3 ⇄ Н + + HCO 3 -
Угольная кислота – слабая неустойчивая кислота, которую в свободном состоянии из водных растворов выделить нельзя.

Карбонаты.
1) Карбонаты металлов (кроме щелочных ) при нагревании разлагаются:
CuCO 3 – tà CuO + CO 2
2) При пропускании углекислого газа из карбонатов образуются гидрокарбонаты:
СаСО 3 + СО 2 + Н 2 О = Са(НСО 3) 2 .
3) Гидрокарбонаты разлагаются до карбонатов: 2NaHCO 3 – tà Na 2 CO 3 + H 2 O + CO 2 .
4) Карбонаты и гидрокарбонаты вступают в обменные реакции:
а) с сильными кислотами (качественная реакция на карбонаты):
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2 ;
б) с растворимыми солями и основаниями, если образуется осадок:
Na 2 CO 3 + Ва(ОН) 2 = ВаСО 3 ↓+ 2NaOH
Na 2 CO 3 + СаСl 2 = СаСО 3 ↓+ 2NaCl
5) Гидрокарбонаты реагируют со щелочами, образуя средние соли:
КНСО 3 + КОН = К 2 СО 3 + Н 2 О
Кремний.
| Расположен в IV группе Периодической системы. На внешнем слое 4 электрона, которые имеют электронную конфигурацию 3s 2 3p 2 . Проявляет степени окисления -4, +2, +4. | Второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Важнейшее соединение кремния - оксид SiO 2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем. SiO 2 необходим для жизни растений и животных. Он придает прочность стеблям растений и защитным покровам животных. Благодаря ему тростники, камыши и хвощи стоят крепко, как штыки, острые листья осоки режут, как ножи, стерня на скошенном поле колет, как иголки, а стебли злаков настолько крепки, что не позволяют ниве на полях ложиться от дождя и ветра. Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, так как содержат кремнезем. |
Физические свойства. Вещество темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см 3 . Полупроводник. В отличие от металлов с повышением температуры его электропроводность увеличивается. На спутниках, космических кораблях и станциях устанавливают солнечные батареи, преобразующие солнечную энергию в электрическую. В них работают кристаллы полупроводников, и в первую очередь кремния.
Кремниевые фотоэлементы могут превратить в электрическую до 10% поглощенной солнечной энергии.
Химические свойства:
Кремний – типичный неметалл, может быть окислителем и восстановителем.
| Взаимодействие с галогенами: непосредственно взаимодействует только с фтором. С хлором реагирует при нагревании. | Si + 2F 2 = SiF 4 Si + 2Cl 2 -tà SiCl 4 |
| Взаимодействие с кислородом | Si + O 2 -tàSiO 2 |
| Взаимодействие с другими неметаллами: С водородом не взаимодействует. | Si + C -tàSiC 3Si + 2N 2 = Si 3 N 4 |
| Взаимодействие с галогеноводородами. С фтороводородом реагирует при обычных условиях, с хлороводородом – при 300 °С, с бромоводородом – при 500 °С. | Si + 4HF = SiF 4 + 2H 2 |
| Взаимодействие с металлами: образует силициды. | 2Ca + Si = Ca 2 Si силицид кальция Si + 2Mg = Мg 2 Si Силициды легко разлагаются водой или кислотами, при этом выделяется газообразное водородное соединение кремния - силан: Мg 2 Si + 2Н 2 SO 4 = 2MgSO 4 + SiH 4 В отличие от углеводородов силан на воздухе самовоспламеняется и сгорает с образованием диоксида кремния и воды: SiH 4 + 20 2 = SiO 2 + 2Н 2 О Повышенная реакционная способность силана по сравнению с метаном СН 4 объясняется тем, что у кремния больше размер атома, чем у углерода, поэтому химические связи -Н слабее связей С-Н. |
| Взаимодействие с кислотами. Устойчив к действию кислот, взаимодействует только со смесью плавиковой и азотной кислот. | 3Si + 4HNO 3 + 18HF = 3H 2 + 4NO + 8H 2 O |
| Растворяется в щелочах, образуя силикат и водород: | Si + 2NaOH + H 2 O = Na 2 SiO 3 + H 2 |
Получение кремния.
Силициды – соединения кремния с металлами, в которых кремний имеет степень окисления -4.
Силициды щелочных и щелочно-земельных металлов характеризуются ионным типом связи, они химически активны. Они легко разлагаются водой или разбавленными кислотами с выделением силана: Ca 2 Si + 2H 2 SO 4 = 2CaSO 4 + SiH 4 .
В силицидах неметаллов ковалентная связь. Среди таких силицидов наибольшее значение имеет карбид кремния – карборунд SiC, имеющий структуру алмаза, он характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах: 2Mg + Si = Mg 2 Si,
2MgO + SiO 2 + 4C = Mg 2 Si + 4CO.
Силан SiH 4 . (моносилан).
Оксид кремния (IV) – кислотный оксид.
В природе – речной песок, кварц.
Не реагирует с водой – т.к. кремниевая кислота нерастворима.
2) При сплавлении реагирует со щелочами: SiO 2 + 2KOH -tàK 2 SiO 3 + H 2 O
3) Реагирует с основными оксидами: SiO 2 + MgО -tàMgSiO 3 и карбонатами щелочных металлов: SiO 2 + K 2 CO 3 -tà K 2 SiO 3 + CO 2 при сплавлении.
4) Из кислот растворяется только в плавиковой : SiO 2 + 6HF = H 2 + 2H 2 O
5) При температуре выше 1000 °С реагирует с активными металлами, при этом образуется кремний: SiO 2 + 2Mg = Si + 2MgO
или при избытке восстановителя – силициды: SiO 2 + 4Mg = Mg 2 Si + 2MgO.
6) Взаимодействие с неметаллами.
Реагирует с водородом: SiO 2 + 2Н 2 = Si + 2Н 2 O,
Взаимодействует с углеродом: SiO 2 + 3С = SiС + 2СO.
Кремниевая кислота.
Имеет полимерное строение и состав xSiO 2 yH 2 O. В водных растворах доказано существование ортокремниевой H 4 SiO 4 , метакремниевой H 2 SiO 3 кислот.

Получение: только косвенным путём, из солей: Na 2 SiO 3 + 2HCl = H 2 SiO 3 ↓ + 2NaCl
Na 2 SiO 3 + 2Н 2 O + 2CO 2 = 2NaHCO 3 + H 2 SiO 3 ↓,
Свойства: 1)Растворяются в концентрированных щелочах: H 4 SiO 4 +4KOH à K 4 SiO 4 + 4H 2 O
2)Разлагаются при нагревании: H 2 SiO 3 -tàSiO 2 + H 2 O
Силикаты.
Большинство нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом». Их водные растворы - это хорошо известный силикатный клей.
Получение: 1) растворение кремния, кремниевой кислоты или оксида в щелочи:
H 4 SiO 4 + 4KOH à K 4 SiO 4 + 4H 2 O
Si + 2NaOH + H 2 O = Na 2 SiO 3 + H 2
SiO 2 + 2KOH -tàK 2 SiO 3 + H 2 O
2) Сплавление оксидов: СаО + SiO 2 -tà CaSiO 3
3) Сплавлением диоксида кремния с карбонатами: SiO 2 + СаС0 3 = СаSiO 3 + С0 2
4) Взаимодействие солей: K 2 SiO 3 + CaCl 2 = CaSiO 3 + 2KCl
Из растворов силикатов действием на них более сильных кислот - соляной, серной, уксусной и даже угольной получается кремниевая кислота Н 2 SiO 3:
К 2 SiO 3 + 2НСl = 2КСl + Н 2 SiO 3
Следовательно, Н 2 SiO 3 очень слабая кислота. Она нерастворима в воде и выпадает из реакционной смеси в виде студенистого осадка, иногда заполняющего компактно весь объем раствора, превращая его в полутвердую массу, похожую на студень, желе. При высыхании этой массы образуется высокопористое вещество - силикагелъ, широко применяемый в качестве адсорбента - поглотителя других веществ.
Прежде всего следует запомнить, что металлы делят в целом на три группы:
1) Активные металлы: к таким металлам относятся все щелочные металлы, щелочноземельные металлы, а также магний и алюминий.
2) Металлы средней активности: к таковым относят металлы, расположенные между алюминием и водородом в ряду активности.
3) Малоактивные металлы: металлы, расположенные в ряду активности правее водорода.
В первую очередь нужно запомнить, что малоактивные металлы (т.е. те, что расположены после водорода) с водой не реагируют ни при каких условиях.
Щелочные и щелочноземельные металлы реагируют с водой при любых условиях (даже при обычной температуре и на холоде), при этом реакция сопровождается выделением водорода и образованием гидроксида металла. Например:
2Na + 2H 2 O = 2NaOH + H 2
Ca + 2H 2 O = Ca(OH) 2 + H 2
Магний из-за того, что покрыт защитной оксидной пленкой, реагирует с водой только при кипячении. При нагревании в воде оксидная пленка, состоящая из MgO, разрушается и находящийся под ней магний начинает реагировать с водой. При этом реакция также сопровождается выделением водорода и образованием гидроксида металла, который, однако, в случае магния нерастворим:
Mg + 2H 2 O = Mg(OH) 2 ↓ + H 2
Алюминий так же, как и магний, покрыт защитной оксидной пленкой, однако в этом случае кипячением ее разрушить нельзя. Для ее снятия требуются либо механическая чистка (каким-либо абразивом), либо ее химическое разрушение щелочью, растворами солей ртути или солей аммония:
2Al + 6H 2 O = 2Al(OH) 3 + 3H 2
Металлы средней активности реагируют с водой лишь тогда, когда она находится в состоянии перегретого водяного пара. Сам металл при этом должен быть нагрет до температуры красного каления (около 600-800 о С). В отличие от активных металлов, металлы средней активности при реакции с водой вместо гидроксидов образуют оксиды металлов. Продуктом восстановления и в этом случае является водород.
ОПРЕДЕЛЕНИЕ
Вода – оксид водорода – бинарное соединение неорганической природы.
Формула – H 2 O. Молярная масса – 18 г/моль. Может существовать в трех агрегатных состояниях – жидком (вода), твердом (лед) и газообразном (водяной пар).
Химические свойства воды
Вода – наиболее распространенный растворитель. В растворе воды существует равновесие, поэтому воду называют амфолитом:
H 2 O ↔ H + + OH — ↔ H 3 O + + OH — .
Под действием электрического тока вода разлагается на водород и кислород:
H 2 O = H 2 + O 2 .
При комнатной температуре вода растворяет активные металлы с образованием щелочей, при этом также происходит выделение водорода:
2H 2 O + 2Na = 2NaOH + H 2 .
Вода способна взаимодействовать с фтором и межгалоидными соединениями, причем во втором случае реакция протекает при пониженных температурах:
2H 2 O + 2F 2 = 4HF + O 2 .
3H 2 O +IF 5 = 5HF + HIO 3 .
Соли, образованные слабым основанием и слабой кислотой, подвергаются гидролизу при растворении в воде:
Al 2 S 3 + 6H 2 O = 2Al(OH) 3 ↓ + 3H 2 S.
Вода способна растворять некоторые вещества металлы и неметаллы при нагревании:
4H 2 O + 3Fe = Fe 3 O 4 + 4H 2 ;
H 2 O + C ↔ CO + H 2 .
Вода, в присутствии серной кислоты, вступает в реакции взаимодействия (гидратации) с непредельными углеводородами – алкенами с образованием предельных одноатомных спиртов:
CH 2 = CH 2 + H 2 O → CH 3 -CH 2 -OH.
Физические свойства воды
Вода – прозрачная жидкость (н.у.). Дипольный момент – 1,84 Д (за счет сильного различия электроотрицательностей кислорода и водорода). Вода обладает самым высоким значением удельной теплоемкости среди всех веществ в жидком и твердом агрегатном состояних. Удельная теплота плавления воды – 333,25 кДж/кг (0 С), парообразования – 2250 кДж/кг. Вода способна растворять полярные вещества. Вода обладает высоким поверхностным натяжением и отрицательным электрическим потенциалом поверхности.
Получение воды
Воду получают по реакции нейтрализации, т.е. реакции взаимодействия между кислотами и щелочами:
H 2 SO 4 + 2KOH = K 2 SO 4 + H 2 O;
HNO 3 + NH 4 OH = NH 4 NO 3 + H 2 O;
2CH 3 COOH + Ba(OH) 2 = (CH 3 COO) 2 Ba + H 2 O.
Один из способов получения воды – восстановление металлов водородом из их оксидов:
CuO + H 2 = Cu + H 2 O.
Примеры решения задач
ПРИМЕР 1
| Задание | Сколько воды надо взять, чтобы из 20%-го раствора уксусной кислоты приготовить 5%-й раствор? |
| Решение |
Согласно определению массовой доли вещества 20%-й раствор уксусной кислоты представляет собой 80 мл растворителя (воды) 20 г кислоты, а 5%-й раствор уксусной кислоты представляет собой 95 мл растворителя (воды) 5 г кислоты.
Составим пропорцию: x = 20 × 95 /5 = 380. Т.е. в новом растворе (5%-м) содержится 380 мл растворителя. Известно, что первоначальный раствор содержал 80 мл растворителя. Следовательно, чтобы получить 5%-й раствор уксусной кислоты из 20%-го раствора нужно добавить: 380-80 = 300 мл воды. |
| Ответ | Необходимо 300 мл воды. |
ПРИМЕР 2
| Задание | При сгорании органического вещества массой 4,8 г образовалось 3,36л углекислого газа (н.у.) и 5,4 г воды. Плотность органического вещества по водороду равна 16. Определите формулу органического вещества. |
| Решение |
Молярные массы углекислого газа и воды, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 44 и 18 г/моль, соответственно. Рассчитаем количество вещества продуктов реакции:
n(СО 2) = V(СО 2) / V m ; n(Н 2 О) = m(Н 2 О) / M(Н 2 О); n(СО 2) = 3,36 / 22,4 = 0,15 моль; n(Н 2 О) = 5,4 / 18 = 0,3 моль. Учитывая, что в составе молекулы СО 2 один атом углерода, а в составе молекулы Н 2 О – 2 атома водорода, количество вещества и массы этих атомов будут равны: n(С) = 0,15 моль; n(Н) = 2×0,3 моль; m(C) = n(С)× M(C) = 0,15 × 12 = 1,8 г; m(Н) = n(Н)× M(Н) = 0,3 × 1 = 0,3 г. Определим, есть ли в составе органического вещества кислород: m(O) = m(C x H y O z) – m(C) – m(H) = 4,8 – 0,6 – 1,8 = 2,4 г. Количество вещества атомов кислорода: n(O) = 2,4 / 16 = 0,15 моль. Тогда, n(C): n(Н): n(O) = 0,15: 0,6: 0,15. Разделим на наименьшее значение, получим n(C):n(Н): n(O) = 1: 4: 1. Следовательно, формула органического вещества CH 4 O. Молярная масса органического вещества рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 32 г/моль. Молярная масса органического вещества, рассчитанная с использованием величины его плотности по водороду: M(C x H y O z) = M(H 2) × D(H 2) = 2 × 16 = 32 г/моль. Если формулы органического вещества выведенного по продуктам сгорания и с использованием плотности по водороду различаются, то отношение молярных масс будет больше 1. Проверим это: M(C x H y O z) / M(CH 4 O) = 1. Следовательно, формула органического вещества CH 4 O. |
| Ответ | Формула органического вещества CH 4 O. |